Assalamu'alaikum Warahmatullahi wabarakatuh...
Hallo
teman-teman! Saat di sekolah kalian pasti sudah dapat pelajaran tentang
KIMIA, pasti udah nggak asing dong mendengar namanya. Hmm.. kalau
begitu apa sih sebenarnya Kimia itu ? Nah kali ini saya akan mengajak
teman-teman membahas tentang Konsep Kimia. Penasaran..? yuk kita
bahas... :)
DEFINISI
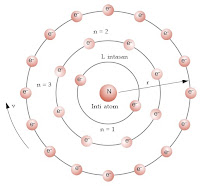
Kimia adalah ilmu yang mempelajari benda, ciri-cirinya, strukturnya, komposisinya, dan perubahannya yang disebabkan karena interaksi dengan benda lain atau reaksi kimia. Kimia fokus dalam mempelajari sebuah materi.
MENGELOMPOKKAN SIFAT-SIFAT MATERI
Materi (zat) adalah segala sesuatu yang memiliki massa dan menempati volume. Materi tersusun atas partikel-partikel, antara partikel satu dengan yang lain terdapat jarak/kerapatan. Perbedaan kerapatan menentukan wujud suatu materi ( Padat, Cair, Gas )
Contoh : Batu, kayu, Daun, Padi Nasi, Air, dan Udara.
Kimia adalah ilmu yang mempelajari benda, ciri-cirinya, strukturnya, komposisinya, dan perubahannya yang disebabkan karena interaksi dengan benda lain atau reaksi kimia. Kimia fokus dalam mempelajari sebuah materi.
MENGELOMPOKKAN SIFAT-SIFAT MATERI
Materi (zat) adalah segala sesuatu yang memiliki massa dan menempati volume. Materi tersusun atas partikel-partikel, antara partikel satu dengan yang lain terdapat jarak/kerapatan. Perbedaan kerapatan menentukan wujud suatu materi ( Padat, Cair, Gas )
Contoh : Batu, kayu, Daun, Padi Nasi, Air, dan Udara.
- Sifat Ekstensif : Sifat materi yang bergantung pada jumlah dan ukuran zat. Misalnya Volume, Massa, dan Berat.
- Sifat Intensif : Sifat materi yang tidak bergantung pada jumlah dan ukuran zat. Misalnya warna, bau, membeku, mencair, melarut, menguap, dan menyumblim.
- Sifat Fisika : Sifat materi yang dapat diamati tanpa materi itu mengalami perubahan yang kekal, seperti warna, bau, rasa, kekerasan, titik didih, dan titik leleh.
- Sifat Kimia : Sifat materi yang diamati saat materi tersebut mengalami perubahan yang kekal, seperti perubahan warna, kereaktifan, kestabilan, dan lain-lain.
Referensi :
https://www.academia.edu/29874278/Makalah_kimia?auto=download