Assalamu'alaikum Warahmatullahi Wabarakatuh...
Berbicara soal Kimia pasti teman-teman sudah tidak asing dengan pelajaran kimia yang satu ini. Yups...kita akan mempelajari beberapa jenis teori atom menurut beberapa ahli, Penasaran ? yuk...langsung saja kita bahas teori tersebut!
A. ATOM

Konsep tentang atom pertama sekali dicetuskan oleh Demokritus, menurut Demokritus semua dapat dipecahkan menjadi partikel terkecil, dimana partikel-partikel tidak bisa lagi dibagi lebih lanjut disebut atom. Atom berasal dari kata atomos, (a: tidak, tomos: memotong), tidak dapat dipotong atau tidak dapat dibagi (Petrucci, 1996).
B. TEORI ATOM
Pendapat tentang susunan zat sudah menjadi perhatian sejak 2500 tahun yang lalu, yaitu sejak jaman yunani kuno. Pendapat ini lebih dikembangkan lagi pada masa Leucippus dan Demokritus yang menyatakan bahwa sesuatu zat tidak dapat dibelah terus menerus tanpa batas, ada bagian yang paling kecil yang tidak dapat dibagi-bagi atau dibelah lagi, itu yang mereka sebut “atomos” yang artinya yang tidak dapat dibagi-bagi lagi. Sebaliknya Aristoteles berpendapat partikel dapat dibelah terus menerus tanpa batas. Pengetahuan tentang atom terus menerus dikembangkan oleh para ilmuan, sehingga sekarang sudah diketahui bagian dan peranannya masing-masing. Ilmuan – ilmuan yang sangat berjasa dalam bidang ini adalah:
1. Jhon Dalton (1760-1844)

Jhon Dalton adalah seorang fisikawan Inggris, yang pada awal abad ke-19 mengemukakan gagasannya tentang atom. Menurutnya atom-atom itu merupakan partikelpartikel yang tidak dapat dibagi lagi. Atom suatu unsur sama segala sifatnya, sedangkan atom dari unsur yang berbeda maka berlainan dalam massa dan sifatnya. Setiap atom dapat membentuk molekul dan senyawa. Selanjutnya beliau juga menegaskan bahwa suatu reaksi kimia hanya melibatkan penata ulang atom-atom, sehingga tidak ada atom yang berubah akibat reaksi kimia (Kartini, 2000).

Teori atom Dalton tersebut ditunjang oleh dua hukum kekekalan alam yaitu hukum kekekalan massa (hukum Lavoisier) yang menyatakan bahwa massa zat sebelum dan sesudah reaksi adalah sama. Dan hukum perbandingan tetap (hukum Proust) yang menyatakan bahwa perbandingan massa unsur-unsur yang menyusun suatu zat adalah tetap.
2. Joseph Jhon Thompson

J.J Thomson adalah fisikawan bangsa Amerika, beliau mengemukakan teorinya bahwa atom memiliki muatan positif yang terbagi merata keseluruh isi atom. Muatan ini dinetralkan oleh elektron-elektron yang tersebar diantara muatan tersebut. Keadaannya mirip roti kismis, dimana elektron diumpamakan sebagai kismis yang tersebar dalam seluruh bagian dari roti (Rachmawati, 2007).

3. Rutherford (1871-1937)

Rutherford adalah seorang ilmuan fisika yang berkecimpung dalam masalah atom, ia telah berhasil menemukan bukti bahwa dalam atom terdapat inti atom yang bermuatan positif yang berukuran jauh lebih kecil dari ukuran atom, tetapi massa atom hampir seluruhnya berasal dari massa intinya. Berdasarkan temuannya tersebut, Rutherford menyusun model atom dan memperbaiki model atom Thomson. Model atom Rutherford mengambarkan atom terdiri atas inti yang bermuatan positif dan berada pada pusat atom, serta elektron bergerak melintasi inti separti halnya planet-planet mengitari matahari.

Beberapa kelemahan dari teori Rutherford tersebut, diantaranya:
1. Tidak dapat menerangkan struktur atom yang stabil,
2. Tidak dapat menerangkan spectrum atom, dan
3. Karena memancar energi, jari-jari elektron akan mengecil dan akhirnya akan bersatu dengan inti, sedangkan kenyataannya tidak.
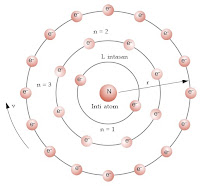
4. Niels Bohr

Kegagalan model atom Rutherford adalah ketidakmampuannya menerangkan mengapa elektron dapat berputar disekeliling inti tanpa ditarik oleh inti sehingga bergabung. Baru pada tahun 1913 Niels Bohr menyusun teori berdasarkan atom Rutherford dan teori kuantum, yaitu:
1. Atom terdiri dari inti yang bermuatan positif dan disekitarnya beredar elektron-elektron yang bermuatan negatif.
2. Dalam atom, elektron beredar mengelilingi inti atom pada orbit tertentu yang dikenal sebagai keadaan gerakan yang stasioner yang selanjutnya disebut dengan tingkat energi utama atau bilangan kuantum atau kulit (n)
3. Sepanjang elektron berada dalam lintasan stasioner energi akan konstan, sehingga tidak ada cahaya yang dipancarkan.
4. Elektron hanya dapat berpindah dari lintasan stasioner yang lebih rendah ke yang lebih tinggi jika menyerap energi. Dan sebaliknya, jika elektron berpindah dari lintasan stasioner yang tinggi ke yang rendah terjadi pembebasan energi (Purba, 1999).
Nomor kulit dan nama kulit dari suatu atom sering disebut dengan bilangan kuantum, tiap-tiap kulit dibagi dalam sub kulit seperti yang terlihat pada tabel di atas. Masing-masing kulit dapat mempunyai elektron maksimum sebesar 2n^2, dimana n adalah bilangan kuantum, tetapi harus didasari pada azas Pauli.
Azas Pauli mengatakan bahwa tidak mungkin ada dua elektron yang memiliki lintasan-lintasan dengan bilangan-bilangan kuantum yang tetap sama. Banyaknya elektron yang diperkenankan dari masing-masing sub adalah: untuk s=2 elektron, p=6 elektron, untuk d=10 elektron dan f=14 elektron.
Namun walaupun demikian teori Niels Bohr juga masih memiliki banyak kelemahan, yaitu: Bohr hanya dapat menerangkan spectrum dari atom yang mengandung satu elektron dan tidak sesuai dengan spectrum atom berelektron banyak. Selain itu dia tidak mampu pula menerangkan atom dapat membentuk molekul melalui ikatan kimia.
Daftar Pustaka :
Kartini, dkk. 2000. Dasar-Dasar Sains Untuk Sekolah Menengah. Jakarta: Bumi Aksara.
Rachmawati, J. 2007. Kimia 1 SMA dan MA. Jakarta: Erlangga.
Purba, M., dkk. 1995. Buku Pelajaran Ilmu Kimia SMU Kelas I, cet.3. Jakarta: Erlangga.
Bermanfaat nih kak
BalasHapusBaguss
BalasHapusMantap
BalasHapusTerimakasih atas ilmunya. Sangat bermanfaat. Ccok buat dijadiin istri
BalasHapusMantap! Sangat bermanfaat:)
BalasHapusBagus
BalasHapusBagus
BalasHapusKereen👌👌
BalasHapusKereen👌👌
BalasHapusKereen👌👌
BalasHapus